Pila Pharma offentliggjorde i fredags deres memorandum forud for den tegningsperiode, der starter i dag, hvor aktionærer har mulighed for at tegne nye aktier.
Målet med emissionen er at fortsætte den kliniske udvikling for selskabets aktiv, molekylet XEN-D0501, i type-2 diabetes og fedme.
Pila Pharma forventer at kunne hente op til 26,2 mio. SEK før omkostninger forbundet med emissionen. Omkostningerne estimeres til at udgøre 1 mio. SEK. Alle eksisterende aktionærer ved markedsluk den 16. november 2023 har modtaget 1 tegningsret per aktie, de ejer. For hver 20 tegningsretter, som en investor besidder, har investoren rettighed til at tegne 19 nye aktier til kurs 1,5 SEK per aktie. Der bliver i alt udstedt op til 17.487.00 nye aktier ifm. emissionen.
Tegningsperioden løber fra i dag den 20. november 2023 til og med den 4. december 2023. Alle tegningsretter der ikke bliver udnyttet, bliver efterfølgende værdiløse og vil blive fjernet fra ens depot. Hvis man ønsker at sælge sine tegningsretter, skal dette gøres senest den 29. november 2023.
Pila Pharma er et biotekselskab, som er noteret på First North GM i Sverige. Selskabet er i klinisk fase-2 med deres lægemiddel, en TRPV1 antagonist, XEN-D0501, der udvikles som behandling mod type-2 diabetes og fedme samt har ”orphan-drug status” til den smertefulde sjældne sygdom erytromelalgi.
Markedet for diabetesmedicin anslås netop nu at være ca. 50 mia. USD årligt, mens markedet for fedmemedicin forventes at være en del større og vokse markant de kommende år, hvilket kan gavne et selskab som Pila Pharma, der udvikler et lægemiddel mod netop type 2 diabetes og fedme.
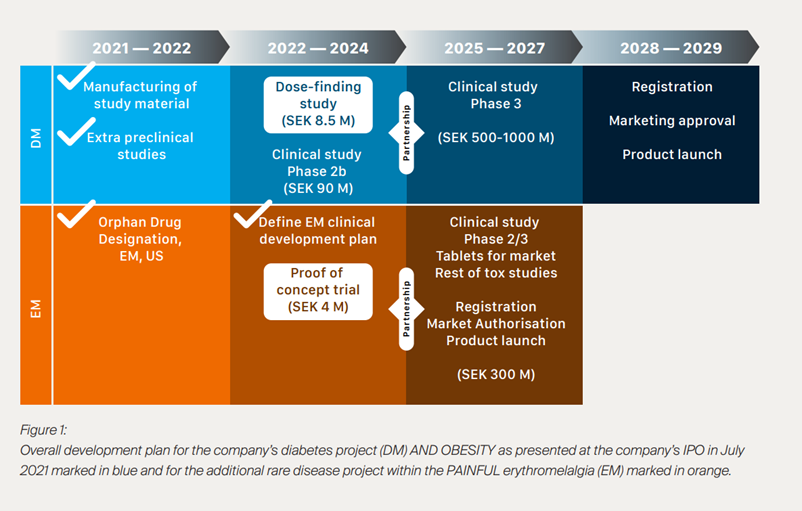
Det næste skridt for Pila Pharma bliver at gennemføre 2 mindre fase 2a studier med XEN-D0501. Dels skal højere doser af XEN-D0501 testes i overvægtige personer med type 2 diabetes for at finde den korrekte dosering af lægemidlet, der skal til for at give en robust effekt på blodsukker og særligt kropsvægt. Dertil skal XEN-D0501 testes for, om det kan sænke smerte oplevelsen under ’flare ups’ i personer med erytromelalgi. Positive resultater af et eller begge af disse to studier kan gøre det muligt at indgå et partnerskab eller potentielt blive opkøbt inden for 1-2 år.
De efterfølgende skridt inden for den kliniske udvikling er at bevise god sikkerhed og signifikante effekter i et større antal patienter. For behandling af erytromelagi vil det kræve et fase 2/3 studie med mulighed for at nå markedet inden for 3-4 år. For behandling af diabetes og fedme vil det kræve fase 2b studier efterfulgt af fase 3 studier med mulighed for at nå markedet inden for de næste 4-5 år. Det kan være en meget kapitaltung proces at bringe et lægemiddel hele vejen til markedet, der også kræver nogle ekspertiser, som et godt udviklingsteam ikke nødvendigvis alene besidder. Derudover er et partnerskab normalvis en generel forudsætning for at nå hele vejen til markedet, og med den store interesse for fedme medicin lige nu mener selskabets ledelse, at det virker sandsynligt med en partnerskabsaftale ved en succesfuld fase-2b.
No comments! Be the first commenter?